Ewing sarkomu
Burada verilen tüm bilgiler genel niteliktedir, tümör tedavisi her zaman deneyimli bir onkologun elindedir!
Eş anlamlı
Kemik sarkomu, PNET (ilkel nöroektodermal tümör), Askin tümörü, Ewing - kemik sarkomu
İngilizce: Ewing sarkomu
tanım
İçinde Ewing sarkomu o bir Kemik iliği dışa dönük Kemik tümörü10 ile 30 yaşları arasında ortaya çıkabilir. Ancak, esas olarak çocukları ve 15 yaşına kadar gençleri etkiler. Ewing sarkomu bundan daha az yaygındır osteosarkom.
Ewing sarkomu uzun olanlarda lokalizedir Uzun kemikler (uyluk (Uyluk kemiği) ve kaval kemiği (Shin)) yanı sıra pelvis veya kaburgalarda. Prensip olarak, gövde ve uzuv iskeletinin tüm kemikleri etkilenebilir, özellikle de metastaz akciğer mümkün.
Sıklık
Ewing sarkomlarının gelişme olasılığı <1: 1.000.000. Araştırmalar, orada yaşayan her milyon insanda her yıl yaklaşık 0.6 yeni hastada Ewing sarkomu geliştirdiğini göstermiştir.
Osteosarkom (yaklaşık% 11) ve kondrosarkom (yaklaşık% 6) ile karşılaştırıldığında, Ewing sarkomu, birincil kötü huylu kemik tümörlerinin bir başka temsilcisi olarak üçüncü sırada yer almaktadır. Ewing sarkomu esas olarak 10 ila 30 yaşları arasında ortaya çıkarken, yaşamın ikinci on yılında (15 yaş) temel bir tezahür ortaya çıkabilir. Bu nedenle, esas olarak büyüyen iskelette ortaya çıkar ve erkeklerde (% 56) kızlardan biraz daha sık Ewing sarkomundan muzdariptir. Çocukların ve ergenlerin birincil kötü huylu kemik tümörlerini karşılaştırırsanız, Ewing sarkomu ikinci sıradadır: Çocukların kemik sarkomlarında, sözde osteosarkomların oranı yaklaşık% 60, Ewing sarkomlarının oranı% 25 civarındadır. .
nedenleri
Özet bağlamında daha önce açıklandığı ve sunulduğu gibi, gelişimden sorumlu olan neden Ewing sarkomu tam olarak açıklığa kavuşturulamaz. Bununla birlikte, Ewing sarkomlarının genellikle ailesel iskelet anormallikleri veya doğumdan itibaren 1 yaşın altındaki hastalar olduğunda ortaya çıktığı bulundu. Retinoblastom (= ergenlik döneminde ortaya çıkan kötü huylu retina tümörü). Araştırmalar, sözde Ewing sarkomları ailesindeki tümör hücrelerinin değiştiğini göstermiştir. Kromozom # 22 sergi. Bu mutasyonun tüm hastaların yaklaşık% 95'inde mevcut olduğuna inanılmaktadır.
yerelleştirme
Ewing sarkomunun en yaygın yerleri, uzun tübüler kemiklerde, özellikle tibia ve fibulada veya düz kemiklerde bulunabilir. Bununla birlikte, kötü huylu bir kemik kanseri olarak Ewing sarkomu tüm kemikleri etkileyebilir. Daha büyük kemikler en sık etkilenirken, daha küçük olanlar nadiren etkilenir. Uzun tübüler kemikler etkilenirse, tümör genellikle diyafiz adı verilen alanda, şaft bölgesinde bulunur.
Tercih edilen yerler:
- yak.% 30 femur (uyluk kemiği)
- yakl.% 12 tibia (incik)
- yaklaşık% 10 humerus (üst kol kemiği)
- yaklaşık% 9 lavabo
- yaklaşık% 8 fibula (fibula).
Erken ortaya çıkan şiddetli hematojenik metastaz nedeniyle (aşağıdaki bölüme bakınız), yumuşak dokularda lokalizasyon da düşünülebilir.
Pelviste lokalizasyon
Ewing sarkomu, pelvik kemikte primer tümör olarak (tümörün menşe yeri) sadece yaklaşık her beş vakada lokalizedir. Bununla birlikte, çok daha sık olarak, birincil tümör uzun bir tübüler kemikte bulunur.
İlk belirtiler pelvik bölgede şişlik, ağrı ve aşırı ısınma olabilir.
Ayakta lokalizasyon
Ayak, birincil tümörde nadir görülen bir yerdir. Tibia veya fibuladaki primer tümörlerin ayakta bir metastazı desteklemesi daha yaygındır.
Özellikle ergenlik döneminde belirsiz ağrılı şişlik ve ayağın aşırı ısınması varsa juvenil artritin yanı sıra Ewing sarkomu da dışlanmalıdır. Burada en kötüsünün varsayılması gerekmez. Görüntüleme şeklindeki hedefli teşhis, şikayetlerin nedenleri hakkında ilk netliği sağlayabilir.
metastaz
Yukarıda belirtildiği gibi, bu geçerlidir Ewing sarkomu erken hematojen (= kan dolaşımı yoluyla) metastaz olarak. Metastazlar bu nedenle yumuşak dokuya da yerleşebilir. Bunlardan öncelikle akciğer etkiledi. Bununla birlikte iskelet, kan dolaşımı yoluyla metastazlardan da etkilenebilir.
Ewing sarkomunun erken metastatik olarak sınıflandırılacağı gerçeği, tanı anında tüm vakaların yaklaşık% 25'inde metastazların tespit edilebileceğini gösteren çalışmalarla kanıtlanmıştır. Metastazlar maalesef her zaman keşfedilemeyeceğinden, karanlık oranı muhtemelen çok daha yüksek olacaktır.
Teşhis
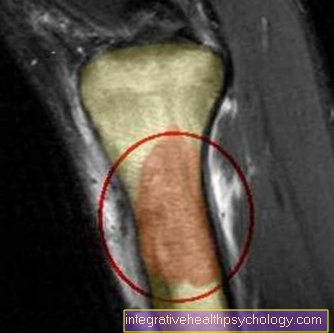
Ewing sarkomları çeşitli semptomlara neden olabilir. Aşağıda listelenmeleri gerekir:
- Nedeni bilinmeyen ağrı
- Etkilenen bölge (ler) de şişme ve genellikle ağrı
- Lenf düğümlerinin şişmesi
- yerel iltihap belirtileri (kızarıklık, şişme, aşırı ısınma)
- istenmeyen kilo kaybı
- Felce kadar fonksiyonel kısıtlamalar
- Kaza olayı olmadan kırılma
- Gece terlemeleri
- orta derecede lökositoz (= kandaki lökosit sayısında artış)
- düşük performans
Klinik, görüntüleme ve laboratuvar teşhislerine göre aşağıdaki kriterler karşılanırsa, yeterli olasılıkla bir tümör ekarte edilebilir:
- Bir kitle kanıtı yok
veya
Görünür şişlik, kanıtlanmış kitle veya belirsiz şikayetler, tümör içermeyen bir hastalıkla açıkça açıklanabilir ve belgelenebilir.
Temel teşhis:
Prensip olarak, temel teşhis için görüntüleme yöntemleri kullanılır. bunlar
X-ışını muayenesi
Tümör lokalizasyonu alanında röntgen muayenesi (en az 2 seviye)
Sonografi
Tümörün sonografisi (özellikle ayırıcı tanıda yumuşak doku tümöründen şüpheleniliyorsa)
Ek bilgi elde etmek ve ayırıcı tanısal sınırlandırmaları etkinleştirmek için laboratuvar teşhisleri (laboratuvar değerlerinin incelenmesi) kullanılır. Bu laboratuvar teşhislerinin bir parçası olarak aşağıdaki değerler belirlenir:
- Kan sayımı
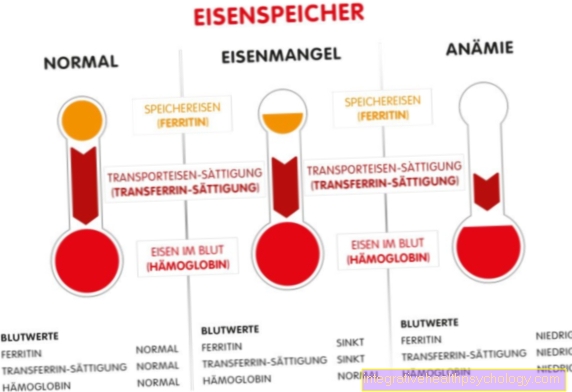
- Demir (çünkü tümörlerde azalma)
- Elektrolitler (hiperkalsemiyi dışlamak için)
- ESR (sedimantasyon hızı)
- CRP (C-reaktif protein)
- alkalin fosfataz (aP)
- kemiğe özgü (AP)
- Asit fosfataz (sP)
- Prostat Spesifik Antijen (PSA)
- Ürik asit (HRS): yüksek hücre devri ile artar, ör. hemoblastozda
- Toplam protein: tüketme süreçlerinde azaldı
Protein elektroforezi - İdrar durumu: paraproteinler - miyelom kanıtı (plazmasitom)
- Tümör belirteci NSE = Ewing sarkomunda nörona özgü enolaz
Özel tümör teşhisi
Manyetik rezonans görüntüleme (MRI)
Temel teşhis bağlamında bahsedilen görüntüleme yöntemlerine ek olarak, manyetik rezonans tomografi bireysel durumlarda kullanılabilecek başka bir seçenektir.
MRI (manyetik rezonans tomografi) kullanılarak, yumuşak doku özellikle iyi bir şekilde gösterilebilir, böylece tümörün etkilenen kemiklerin komşu yapılarına (sinirler, damarlar) genişlemesi gösterilebilir. Ayrıca, tümör hacmi MRI (manyetik rezonans tomografi) kullanılarak tahmin edilebilir ve tümörün lokal boyutu netleştirilebilir.
Kötü huylu bir kemik tümöründen şüphelenildiğinde, metastazları (kötü huylu yerleşimler) dışlamak için tümör taşıyan kemiğin tamamı görüntülenmelidir.
Bilgisayarlı Tomografi (CT):
(özellikle sert (kortikal) kemik yapılarını göstermek için)
Pozitron Emisyon Tomografisi (PET)
(Değer henüz yeterince geçerli değil)
Konuyla ilgili daha fazlasını okuyun: Pozitron emisyon tomografi
Tümör damarlarını görselleştirmek için dijital çıkarma anjiyografisi (DSA) veya anjiyografi
İskelet sintigrafisi (3 fazlı sintigrafi)
biyopsi
Yukarıda birkaç kez bahsedildiği gibi, örneğin Ewing sarkomu ile osteomiyelit arasındaki ayrım oldukça zor olabilir. Semptomların benzer olmasına ek olarak, röntgen her zaman doğrudan bilgi sağlayamaz. Yukarıda açıklanan sözde invazif olmayan tanıdan sonra, hala bir tümör şüphesi varsa veya bir tümörün tipi ve saygınlığı net değilse, bir histopatolojik inceleme (= doku incelemesi) yapılmalıdır.
Açık prosedürler
Kesi biyopsisi
İnsizyonel biyopsinin bir parçası olarak, tümör kısmen cerrahi olarak açığa çıkarılır. Son olarak bir doku örneği alınır (mümkünse kemik ve yumuşak doku). Çıkarılan tümör dokusu doğrudan değerlendirilebilir.
Eksizyonel biyopsi (tam tümör çıkarılması)
Sadece istisnai durumlarda, örneğin daha küçük osteokondromlarda malignite (iyi huyludan kötü huylu tümöre geçiş) şüphesi varsa dikkate alınır.
terapi
Buradaki terapötik yaklaşım genellikle birkaç düzeydedir. Bir yandan, sözde terapi planı genellikle ameliyat öncesi kemoterapötik tedavi sağlar (= neoadjuvan kemoterapi). Ewing sarkomunun cerrahi olarak çıkarılmasından sonra bile, terapötik takip tedavisi radyasyon tedavisi ve gerekirse yenilenen kemoterapi ile sağlanır. Burada osteosarkomdan bir fark fark edilir hale gelir: Ewing sarkomu ile karşılaştırıldığında, osteosarkom daha düşük radyasyon duyarlılığına sahiptir.
Terapi hedefleri:
Özellikle Ewing sarkomu lokalize olan ve herhangi bir metastaz göstermeyen hastalarda iyileştirici (iyileştirici) terapötik yaklaşım verilmektedir. Bu arada, neoadjuvan kemoterapi adı verilen tedavi, cerrahi ve radyasyon terapisi ile birlikte daha fazla fırsat yaratıyor. Ewing sarkomu akciğerlerin dışına metastaz yaparsa (= genel tümör hastalığı; ekstrapulmoner metastazlar), tedavi genellikle palyatiftir (yaşam uzatır) (aşağıya bakınız).
Terapi modaliteleri:
yerel:
- ameliyat öncesi kemoterapi
- cerrahi tedavi (Enneking'den sonra geniş veya radikal rezeksiyon)
- radyoterapi
sistemik:
antineoplastik kemoterapi
- Kombinasyon tedavisi (öncelikle (= "birinci sıra"): doksorubisin, ifosfamid, metotreksat / Lökovorin, cisplatin; ikinci satırda (= "ikinci satır"): etoposide ve carboplatin)
(Protokoller kısa sürede değişebilir)
Küratif tedavi:
- ameliyat öncesi ve sonrası agresif çok maddeli kemoterapi
- Tek başına cerrahi tümör rezeksiyonu veya radyasyon şeklinde lokal tedavi
- Tedaviyi şununla tamamlayın: Ön ışınlama (örneğin ameliyat edilemeyen tümörler, yanıt vermeyenler durumunda) veya ışınlama sonrası
- Cerrahi tedavi bağlamında, cerrahi yöntemlerin daha da gelişmesi nedeniyle, çoğu durumda ekstremiteleri koruyan müdahalelerin mümkün olduğunu belirtmek önemlidir. Bununla birlikte, bir tedavi olasılığı her zaman en yüksek önceliğe sahiptir, bu nedenle odak her zaman radikallik (= onkolojik kalite) olmalıdır ve olası işlev kaybına değil.
- Kemoterapiye daha sonra devam edilebilir (yukarıya bakın). Biri sözde bir konsolidasyondan bahsediyor.
- Akciğer metastazı olan hastalarda, akciğerlerin kısmen alınması gibi akciğer bölgesinde ek müdahaleler gerekli olabilir.
Palyatif (yaşam uzatan) tedavi:
Genel bir tümör hastalığı (= ekstrapulmoner metastazlar) olan hastalar, gövde üzerindeki birincil tümörü konumlandırmalıdır ve / veya birincil tümörün ameliyat edilemez olduğu kanıtlanır. Bu gibi durumlarda genellikle sadece palyatif tedavi mümkündür. Bu gibi durumlarda, odak noktası genellikle yaşam kalitesini sürdürmektir, böylece terapi ağrının giderilmesine ve işlevin sürdürülmesine odaklanır.
tahmin
Nükslerin meydana gelip gelmediği büyük ölçüde metastazın derecesine, ameliyat öncesi kemoterapiye verilen yanıta ve tümörün çıkarılmasının “radikal doğasına” bağlıdır. Şu anda beş yıllık sağkalım oranının% 50 civarında olduğuna inanılıyor. Özellikle operasyonel iyileştirmeler, son 25 yılda hayatta kalma olasılığını artırmayı mümkün kılmıştır.
Hayatta kalma oranı birincil metastazlarla azalır. Burada hayatta kalma oranı% 35 civarındadır.
İyileşme şansı
Diğer kanserlerde olduğu gibi, Ewing sarkomundan iyileşme şansı başlangıçta bireysel olarak farklı görülmelidir, çünkü istatistikler sadece ortalama iyileşme ve hayatta kalma oranlarını gösterir.
Tümör cerrahi olarak tamamen çıkarılabilirse iyileşme şansı artar. Bundan önce tümörü küçültmek için kemoterapi yapılmalıdır. Tümör cerrahi olarak çıkarıldıktan sonra, kalan tümör hücrelerini öldürmek için daha fazla kemoterapi uygulanmalıdır.
Tümör cerrahi olarak tamamen çıkarılamazsa, iyileşme şansı çok daha kötüdür. Kemoterapi ile takip tedavisi de burada yapılmalıdır.
Ameliyat edilemeyen bir tümör mutlaka ışınlanmalıdır.
Genel olarak, eğer tanı anında metastazlar mevcutsa, Ewing sarkomu için bir tedavi olasılığının daha zayıf olduğu söylenebilir. Bu, tümörün vücudun başka yerlerinde de yayıldığı ve büyüdüğü anlamına gelir.
Hayatta kalma oranı
Genel olarak sağkalım oranları tıpta “5 yıllık sağkalım oranının” istatistiksel değeri olarak verilmektedir. Bu, tanımlanmış bir hasta grubunda 5 yıl sonra hayatta kalanların sayısının ne kadar büyük olduğunu yüzde olarak gösterir. Ewing sarkomu için bildirilen hayatta kalma oranı% 40 ile% 60-70 arasında değişmektedir. Bu geniş alanlar, hayatta kalma oranının ilgili kemik bölgesinin istilasına bağlı olmasından kaynaklanmaktadır. Örneğin kol ve / veya bacak kemikleri etkilenmişse 5 yıllık sağkalım oranı% 60-70'dir. Pelvik kemikler etkilenmişse% 40'tır.
Tekrarlama riski ne kadar yüksek?
5 yıllık hayatta kalma oranı ortalama% 50'dir. Burada agresif ve kötü huylu bir kanser olduğu varsayılabilir. 5 yıllık hayatta kalma oranı, teşhis edilen tüm Ewing sarkomlarının ortalama yarısının ölüme yol açtığını söylüyor.
Ancak Ewing sarkomunun başarılı bir şekilde tedavi edilmesinden 5 yıl sonra başka bir bulgu tespit edilemezse kanserin iyileştiği söyleniyor.
tamamlayıcı tedavi
öneriler:
- 1. ve 2. yılda:
Her üç ayda bir klinik muayene yapılmalıdır. Kural olarak, yerel bir X-ışını kontrolü, laboratuvar testleri, göğüs ve tam vücut iskelet sintigrafisi yapıldı. Yerel bir MRG genellikle altı ayda bir yapılır. - 3 ila 5. yılda:
Altı ayda bir klinik muayene yapılmalıdır. Kural olarak, yerel bir X-ışını kontrolü, laboratuvar testleri, göğüs ve tam vücut iskelet sintigrafisi yapıldı. Yerel bir MRG genellikle yılda bir yapılır. - 6. yıldan itibaren, aşağıdakiler genellikle yılda bir gerçekleşir:
laboratuar muayenesi ve göğüs BT'sinin yanı sıra tüm vücut iskelet sintigrafisi ve yerel bir MRI ile bir X-ışını kontrolü.
özet
Hastalık (Ewing sarkomu) adını James Ewing'in 1921'de yaptığı ilk açıklamadan almıştır. Bunlar dejenere ilkel nöroektodermal hücrelerden (= sinir hücrelerinin olgunlaşmamış öncü hücreleri) ortaya çıkan oldukça kötü huylu tümörlerdir. Bu nedenle Ewing sarkomları ilkel, kötü huylu, katı tümörlere aittir.
Yukarıda bahsedildiği gibi, Ewing sarkomları esas olarak uzun tübüler kemiklerin orta bölgelerini ve pelvisi etkiler, ancak üst kolda (= humerus) veya kaburgalarda bir rahatsızlık da düşünülebilir, böylece osteosarkoma paralellikler ortaya çıkar. Eşlik eden iltihap belirtileri nedeniyle, osteomiyelit ile karışıklık mümkündür.
Çok hızlı meydana gelen metastazlar nedeniyle (tüm hastaların yaklaşık'ü tanı anında zaten yavru yerleşimlerini göstermektedir), Ewing sarkomları rabdomyosarkomlara benzer şekilde yumuşak dokuda da bulunabilir. Akciğerler genellikle metastazdan en çok etkilenir.
Ewing sarkomunun gelişiminden sorumlu tutulabilecek nedenler hala bilinmemektedir. Ancak, şu anda ne genetik bileşenin (kalıtım) ne de halihazırda uygulanmış olan radyasyon tedavisinin gelişimden sorumlu tutulamayacağı varsayılmaktadır. Bununla birlikte, Ewing sarkomlarının sıklıkla ailesel iskelet anormallikleri olduğunda veya hastalar doğumdan itibaren retinoblastomdan (= ergenlik döneminde meydana gelen habis retina tümörü) muzdarip olduğunda ortaya çıktığı bulunmuştur. Araştırmalar, sözde Ewing sarkom ailesinin tümör hücrelerinin 22 numaralı kromozomda bir değişiklik gösterdiğini göstermiştir. Bu mutasyonun (genetik değişim) tüm hastaların yaklaşık% 95'inde mevcut olduğu varsayılmaktadır.
Ewing sarkomları, etkilenen bölgede / bölgelerde şişlik ve ağrıya neden olabilir ve bu da fonksiyonel bozukluklarla ilişkilendirilebilir. Ateş ve orta derecede lökositoz (= kandaki lökosit sayısında artış) da düşünülebilir. Örneğin osteomiyelit ile karıştırılma olasılığı nedeniyle (yukarıya bakınız), bir teşhis her zaman kolay değildir ve görüntüleme prosedürlerine (X-ışını incelemesi) ek olarak, bir biyopsi (= doku örneğinin doku incelemesi) gerekli olabilir.
Buradaki terapötik yaklaşım genellikle birkaç düzeydedir. Bir yandan, sözde tedavi planı genellikle ameliyat öncesi kemoterapötik tedavi sağlar (= neoadjuvan kemoterapi). Ewing sarkomunun cerrahi olarak çıkarılmasından sonra bile, terapötik takip tedavisi radyasyon tedavisi ve gerekirse yenilenen kemoterapi ile sağlanır. Burada osteosarkomdan bir fark fark edilir hale gelir: Ewing sarkomu ile karşılaştırıldığında, osteosarkom daha düşük radyasyon duyarlılığına sahiptir.
Nükslerin (yenilenmiş tümör büyümesi) gelişip gelişmeyeceği, büyük ölçüde metastazın derecesine, ameliyat öncesi kemoterapiye verilen yanıta ve tümörün çıkarılmasının "radikal doğasına" bağlıdır. Şu anda beş yıllık sağkalım oranının% 50 civarında olduğuna inanılıyor. Özellikle operasyonel iyileştirmeler, son 25 yılda hayatta kalma olasılığını artırmayı mümkün kılmıştır.